 7
7
我们可以为您提供的自主服务项目主要有:
出口欧洲法规:欧盟CE认证(CE整套技术文件编订、 CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书、防护服PPE指令Type5/6认证
出口美国法规:医疗器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系辅导、食品FDA验厂辅导及整改、OTC药品FDA验厂辅导及整改
中国法规:医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证辅导、SFDA验厂辅导、SFDA注册检测、企业标准编制、药监局自由销售证。
出口其余国际法规:医疗器械单一体系审核MDSAP认证、澳大利亚TGA注册、BSCI验厂辅导、ISO22716 GMPC验厂辅导、BRC 认证,口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试
医疗器械法规(MDR)转换期为3年,2020年5月4日起强制实行。体外诊断器械法规(IVDR)转换期为5年,2022年5月4日起强制实行。MDR将有源医疗器械指令(现行的90/385/EEC)纳入了进来,与一般医疗器械指令(现行93/42/EEC)合二为一,IVDR直接取代了现行的体外诊断医疗器械指令98/79/EEC。
我司注意到新法规主要在以下几点上发生了变化:
1.医疗器械的定义;
2.医疗器械的分类;
3.基本安全和性能要求;
4.技术文件要求;
5.临床评价;
6.上市后监管;
7.Eudamed数据库;
8.对NB公告机构的监管要求(新法规生效后NB将按照新的要求重新进行授权);
9.对高风险医疗器械的新增了要求;
总的说来新的MDR和IVDR加强了体系管理,对高风险设备增加了相关规定比如对于非医疗用途但具有与医疗器械相似特性的设备也将受到新法规的管辖(如用于美容的彩色隐形眼镜),提升了产品对患者的透明度和可追溯性并设立电子数据库(Eudamed)、医疗设备将有一个的识别号这加强其在整个供应链的可追溯性。
2019年2月医疗器械法规(MDR)和体外诊断医疗器械法规(IVDR)终提案发布,2019年3月7日欧盟28个成员国一致投票表决同意欧盟采用新版的医疗器械法规(MDR)和体外诊断器械法规(IVDR)。2019年5月5日,欧盟正式发布了OfficialJournal其正式对外宣布了新版MDR(REGULATIONEU2019/745)法规和新的IVDR(REGULATIONEU2019/746)法规。新法规将取代现行的三个医疗器械指令:分别是医疗器械指令93/42/EEC,有源医疗器械指令90/385/EEC及体外诊断医疗器械指令98/79/EEC。
2019年5月5日欧盟发布OfficialJournal
在这里我司需要特别说明的是欧盟此次是直接发布的Regulation(法规)而相比较之前的Directive(指令)其区别在于:提高了文件的约束力,发布立即在欧盟成员国生效并成为有约束力的法律,此次的Regulation*向Directive那样需要经过成员国转化成当地法律法规去落实实施。
我们可以为您提供的自主服务项目主要有:
出口欧洲法规:欧盟CE认证(CE整套技术文件编订、 CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书、防护服PPE指令Type5/6认证
出口美国法规:医疗器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系辅导、食品FDA验厂辅导及整改、OTC药品FDA验厂辅导及整改
中国法规:医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证辅导、SFDA验厂辅导、SFDA注册检测、企业标准编制、药监局自由销售证。
出口其余国际法规:医疗器械单一体系审核MDSAP认证、澳大利亚TGA注册、BSCI验厂辅导、ISO22716 GMPC验厂辅导、BRC 认证,口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试
专业办理出口:美国FDA注册(含FDA510K申请)、 FDA QSR820验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL/QSR820体系辅导/OTC验厂辅导及整改、CE认证(CE整套技术文件编订、 CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016、欧盟授权代表、欧盟自由销售证书、英国BRC认证咨询,BSCI验厂辅导;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令辅导)。
2019年2月医疗器械法规(MDR)和体外诊断医疗器械法规(IVDR)终提案发布,2019年3月7日欧盟28个成员国一致投票表决同意欧盟采用新版的医疗器械法规(MDR)和体外诊断器械法规(IVDR)。2019年5月5日,欧盟正式发布了OfficialJournal其正式对外宣布了新版MDR(REGULATIONEU2019/745)法规和新的IVDR(REGULATIONEU2019/746)法规。新法规将取代现行的三个医疗器械指令:分别是医疗器械指令93/42/EEC,有源医疗器械指令90/385/EEC及体外诊断医疗器械指令98/79/EEC。
新MDR不仅包含了MDD及AIMDD涵盖的所有产品;还覆盖专门用于器械的清洁、消毒或灭菌的器械,以及Annex XVI列举的无预期医疗目的的产品,如美瞳、面部填充或注射、纹身、皮肤改善和美容等产品。
包含某些药械结合产品,详细请见Article1(8,9)。
包含某些由非活性或处理为非活性的人类来源组织或细胞物制造的特定产品。
包含声称仅具有美容目的或另一种非医疗目的,但在功能和风险特征方面类似于医疗器械的特定产品组
声明纳米材料器械属于MDR范围,且要接受为严格的评估程序。
包含发射离子辐射的器械和医疗用途的软件。
MDR框架
Chapter I – Scope and Definitions
Chapter II – CE Marking, Economic Operators, Reprocessing
Chapter III – Identification and Traceability of Devices
Chapter IV – Notified Bodies
Chapter V – Classification and Conformity Assessment
Chapter VI – Clinical Evaluation and Investigation
Chapter VII – Vigilance and Market Surveillance
Chapter VIII – Cooperation between Member States
Chapter IX – Confidentiality, Data Protection, Funding, Penalties
Chapter X – Final Provisions
100 whereas= Why?
X Chapters of 123 Articles = What?
XVI I Annexes = How?
I General safety and performance requirements
II Technical documentation
III Technical documentation on post-market surveillance
IV EU Declaration of conformity
V CE marking of conformity
VI European UDI System
VII Requirements to be met by notified bodies
VIII Classification rules
IX Conformity assessment based on a QMS and assessment of the technical documentation
X Conformity assessment based on type examination
XI Conformity assessment based on product conformity verification
XII Certificates issued by a notified body
XIII Procedure for custom-made devices
XIV Clinical evaluation and post-market clinical follow-up
XV Clinical investigations
XVI List of groups of products without an intended medical purpose
XVII Correlation table
内容 涉及章节
范围&定义 Chapter I
产品上市 Chapter II
UDI & 数据库 Chapter III, Annex VI,XII
NB Chapter IV , Annex VII,
符合性评估 Chapter V, Annex IX, X, XI
临床评价和临床调查 Chapter VI, Annex XIV ,XV
PMS, 警戒系统,上市后监管 Chapter VII , Annex XIV
Standards, timeline, MDCG Chapter VIII
Classification Annex VIII
一般安全性能要求(ER checklist) Annex I
TD要求 Annex II, III
DoC &CE marking Annex IV, V
Custom-made Annex XIII
非医疗器械产品清单 & 指令、法规对比表 Annex XVI, XVII
我们可以为您提供的自主服务项目主要有:
出口欧洲法规:欧盟CE认证(CE整套技术文件编订、 CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书、防护服PPE指令Type5/6认证
出口美国法规:医疗器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系辅导、食品FDA验厂辅导及整改、OTC药品FDA验厂辅导及整改
中国法规:医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证辅导、SFDA验厂辅导、SFDA注册检测、企业标准编制、药监局自由销售证。
出口其余国际法规:医疗器械单一体系审核MDSAP认证、澳大利亚TGA注册、BSCI验厂辅导、ISO22716 GMPC验厂辅导、BRC 认证,口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试
MDR&IVDR修订要点
1) 强化符合性评审程序, 临床试验和临床评估, 警戒系统和市场监督系统, 确保医疗
器械的透明和可追溯性
2) MDD + AIMD →MDR; IVDD →IVDR
3) 药品, 化妆品和食品不在MDR/IVDR的范围内
4) MDR包括含有无活性的人组织或细胞的医疗器械
5) 无医疗用途, 但功能和风险与医疗器械类似的产品也纳入MDR
6) 含纳米材料的医疗器械要进严格的评估
定义: Commission Recommendation 2011/696/EU (OJ L 275, 20.10.2011, p.
38).
7) 电子商务服务 Information Society Service要符合Directive (EU) 2015/1535
8) 通用规范CS (Common Specification)
9) 规定经销链相关方 (Economic Operator) 的职责
10) MDD/AIMD中的Annex 的临床评估 或警戒系统纳入到了MDR的正文里
11) 医疗机构内部使用的器械
12) 缺陷产品对患者的补偿
13) 风险管理和临床评估互相依赖, 定期更新
14) 法规负责人需要满足要求, 负责监督和和控制医疗器械的生产, PMS和警戒
系统的活动. ---- 类似于质量授权人
15) 欧盟代表与进口商和制造商一起起到连带责任
欧盟代表要求, 类似于法规负责人
16) 平行贸 Parallel Trade, 特别是重新贴标签或重新包装
17) 一次性医疗器械的再加工和使用:
- 符合成员国的法规要求
- 再加工方要承担法定制造商的责任;
- 由医疗机构或外部加工方进行的一次性MD的再加工和再使用必须要符合通用
技术规范或协调标准或成员国的法规要求.
- 再加工器械的安全和性能应等同于初期的一次性MD
18) 植入器械: 患者应获得基本的信息, 包括标识, 危害健康的警示或注意事项
19) 带有CE标记的MD, 在欧盟内可以自由流通和销售. 但成员国可以限制某些器械
的使用.
20) 除了定制器械外, 所有器械都应应用UDI系统 (MDR执行后1-5年)
21) EUDAMed, MD的 命名Code
22) 植入和III类产品的制造商应公开产品的主要安全和性能, 及临床评估结果的概要.
- 安全和性能的概要应特别包括该产品在与其他诊断或**方法比较时的重要性,和二者的特殊使用条件
23) 在欧盟的层面上管理NB
24) 主管当局严格监控NB对技术文档, 特别是临床评估的评审
25) NB的飞行检查, 并对产品进行外观或实验室测试
26) 对输入或导出药物的III类植入产品和IIb有源产品, 欧盟*的*组应复审企业的临床评估报告, 并通告主管当局
27) III类产品和某些IIb产品, 制造商在临床评估或临床试验之前, 可以自愿地与*组联系, 咨询临床开发策略和临床试验方案.
28) 符合性评估时的产品分类: 按照国际实践分为四大类; 有源植入器械分为
---- (59)
29) Class III custom-made implantable devices 需要CE认证
30) 明确CE技术文件要求(Annex II & III)
我们可以为您提供的自主服务项目主要有:
出口欧洲法规:欧盟CE认证(CE整套技术文件编订、 CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书、防护服PPE指令Type5/6认证
出口美国法规:医疗器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系辅导、食品FDA验厂辅导及整改、OTC药品FDA验厂辅导及整改
中国法规:医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证辅导、SFDA验厂辅导、SFDA注册检测、企业标准编制、药监局自由销售证。
出口其余国际法规:医疗器械单一体系审核MDSAP认证、澳大利亚TGA注册、BSCI验厂辅导、ISO22716 GMPC验厂辅导、BRC 认证,口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试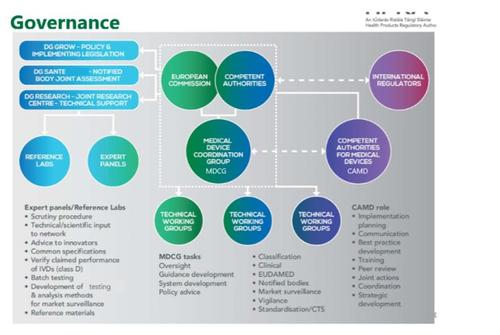
通用规范
Reprocessing of Single-use Medical Devices
一次性医疗器械的再评审
Economic Operators
• 提出了新的概念Economic Operators经销链相关方,包括:制造商,欧盟授权代表,进口商和分销商
• 另新增加的要求:
• 各方都要明确其上游和下游的器械供应商;以及将器械直接供给的卫生机构或医疗保健专业人员(Article 25).
• Store and keep the UDI for implantable devices by economic operators (Article 27.8)
• Electronic system for registration of economic operators (Article 30+Annex VI, Part A)
Regulatory compliance
• It should be ensured that supervision and control of the manufacture of devices, and the post-market surveillance and vigilance activities concerning them, are carried out within the manufacturer’s organisation by a person responsible for regulatory compliance who fulfils minimum conditions of qualification.
• The authorised representative plays a pivotal role in ensuring the compliance of the devices produced by those manufacturers and in serving as their contact person established in the Union… legally liable for defective devices in the event that a manufacturer
established outside the Union has not complied with its general
obligations
我们可以为您提供的自主服务项目主要有:
出口欧洲法规:欧盟CE认证(CE整套技术文件编订、 CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书、防护服PPE指令Type5/6认证
出口美国法规:医疗器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系辅导、食品FDA验厂辅导及整改、OTC药品FDA验厂辅导及整改
中国法规:医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证辅导、SFDA验厂辅导、SFDA注册检测、企业标准编制、药监局自由销售证。
出口其余国际法规:医疗器械单一体系审核MDSAP认证、澳大利亚TGA注册、BSCI验厂辅导、ISO22716 GMPC验厂辅导、BRC 认证,口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试
MDR分类规则的主要变化
• 仍为4类: Class I, IIa, IIb, III
• Duration of Use (无变化)
-Transient < 60 minutes;
- 60minutes < Short-term<30 days;
- Long term > 30 days
• 18 个规则=> 22个规则
- Rule 1-4 Non invasive devices
- Rule 5-8 Invasive devices
- Rule 9-12 Active devices
- Rule 13-22 Special rules
分类规则: 1-4 Non invasive devices
Rule 3:
• 在原来基础上, 新增由一种或几种物质混合组成的非侵入器械,其预期用于直接在体外接触已从人体或人体胚胎中取出且还未被植入人体的细胞、组织或器官,该类器械属于III类。
分类规则: 5-8 Invasive devices
Rule 6、 7:
• 在原来基础上, 新增专门用于直接接触心脏或循环系统的短暂、短期使用型侵入性手术器械属于III类
MDR分类规则的主要变化
分类规则: 5-8 Invasive devices
Rule 8:
• 在原来基础上,明确有源植入器械或其附件属于III类; 新增假体属于III类;关
节的全部或部分置换物(除钉、楔、板和工具等辅助组件外)属于III类;除钉、楔、
板和工具等组件外的植入性椎间盘置换物和接触脊柱的植入器械属于III类。
这部分的修订取代了现有的指令:
• 90/385/EEC Active implant medical device
• 2003/12/EC Breast implants raised to Class III
• 2005/50/EC Hip, knee and shoulder joint replacements raised to Class III
分类规则: 9-12 Active devices
Rule 9:
• 在原来基础上, 增加对发射电离辐射达到**目的的有源器械,以及控制、监控这些器械或直接影响这些器械性能的有源器械属于IIb类;
• 在原来基础上, 增加预期用于控制、监视或直接影响有源植入器械性能的有源器械属于III类
2016年12月14日,EUDAMED(European databank for medical devices) 筹划指导会上欧盟各国对于医疗器械法规MDR及IVDR的执行进行了一轮的讨论,与会人员对于这两个法规的细节内容进行了讨论并达成了一致意见。在此基础上,会议对于MDR及IVDR的执行达成了如下时间表。
MDR实施之后,在三年过渡期内仍然可以按照MDD和AIMDD申请CE证书并保持证书的有效性。依据Article 120 clause2 的规定,过渡期内NB签发的CE证书继续有效,但是从其交付日期起有效期不**过5年,并且于2024年5月27日失效
我们可以为您提供的自主服务项目主要有:
出口欧洲法规:欧盟CE认证(CE整套技术文件编订、 CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书、防护服PPE指令Type5/6认证
出口美国法规:医疗器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系辅导、食品FDA验厂辅导及整改、OTC药品FDA验厂辅导及整改
中国法规:医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证辅导、SFDA验厂辅导、SFDA注册检测、企业标准编制、药监局自由销售证。
出口其余国际法规:医疗器械单一体系审核MDSAP认证、澳大利亚TGA注册、BSCI验厂辅导、ISO22716 GMPC验厂辅导、BRC 认证,口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试
专业办理出口:美国FDA注册(含FDA510K申请)、 FDA QSR820验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL/QSR820体系辅导/OTC验厂辅导及整改、CE认证(CE整套技术文件编订、 CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016、欧盟授权代表、欧盟自由销售证书、英国BRC认证咨询,BSCI验厂辅导;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令辅导)。
我们可以为您提供的自主服务项目主要有:
出口欧洲法规:欧盟CE认证(CE整套技术文件编订、 CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书、防护服PPE指令Type5/6认证
出口美国法规:医疗器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系辅导、食品FDA验厂辅导及整改、OTC药品FDA验厂辅导及整改
中国法规:医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证辅导、SFDA验厂辅导、SFDA注册检测、企业标准编制、药监局自由销售证。
出口其余国际法规:医疗器械单一体系审核MDSAP认证、澳大利亚TGA注册、BSCI验厂辅导、ISO22716 GMPC验厂辅导、BRC 认证,口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试
MDR&IVDR法规的变化(3)
4. 细化注册要求
General Safety and Performance Requirements
CE技术文件的要求
DOC的要求
NB的授权要求
Implant Card for implanted device
5. 加强市场监管要求
UDI要求
Eudamed数据库
加强欧盟成员国之间的监管协作
NB应满足的要求-Annex VII
• MDR对NB的要求更加严格
• NB的授权和监管由多个国家主管当局联合组成的审核小组进行审核;
• NB必须要有自己的审核*团队,新法规下对外聘*的做法将有所限制;
• NB必须要有自己的临床*,而不能仅靠外部临床*进行相关审核。
• 新法规生效后, NB将按照新的要求重新授权,不符合要求的NB将会被淘汰。
• 对于已经取得CE证的企业,应密切关注其NB的新授权以及授权范围!!
与高风险MD有关的新要求
• 对于III类植入器械和用于注入和/或移除药物的IIb类有源器械,其临床评价报告,除了NB审核以外,还需要由NB交至主管当局进行expertpanel review,综合意见进行审评。
• 对于III类和植入器械(顾客定制除外) , 制造商应提交Summary of safety and clinical performance至NB。经NB审核后上传至EUDA MED数据库,供公众查询。
The manufacturer shall mention
on the label or instruc- tions for
use where the summary is available .(Article 32)